روابط حجمی گازها در محاسبات استوکیومتری

ژوزف لویی گی لو ساک (1850-1788) شیمی دان و فیزیک دان فرانسوی اولین کارها را برای محاسبه حجمی در گازها انجام داد و نتایج آزمایش های او به قانون نسبت های ترکیبی معروف می باشد.
شایان ذکر است که نسبت های حجمی، همان نسبت ضریب های مواد گازی در معادله ی واکنش های شیمیایی موازنه شده است.
قانون گیلو ساک به این اشاره دارد که در دما و فشار ثابت نسبت حجمی گازها در یک واکنش شیمیایی متناسب با نسبت مول آن ها در معادله ی موازنه شده ی واکنش است.
به مثال زیر توجه کنید:
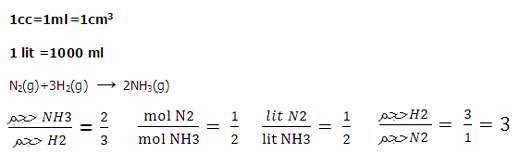
به عبارت دیگر می توان گفت که در فشار و دمای ثابت یک مول از گازهای مختلف حجم ثابت و برابری دارند. این نتیجه گیری نخستین بار توسط آووگادرو و در سال 1811 بیان شد، فرضیه ای که بعد ها به قانون آووگادرو معروف شد.

می دانید که حجم گازها تابعی از فشار و دمای آنها است. شرایط STP که مخفف standard temperature and pressure که شرایط استاندارد معروف است شرایطی است که دمای گاز 0° c (273k) و فشار یک اتمسفر (760 میلی متر جیوه = 76 سانتی متر جیوه) می باشد و حجم گاز در این شرایط داده می شود. در شرایط STP، حجم ، حجم هر مول گاز برابر 22/4L است که این حجم به حجم مولی گازها در شرایط STP معروف است.
توجه کنید که عبارات زیر همه با هم در شرایط STP برای یک گاز برابر است؛ برای مثال یک عدد گاز N2 را در نظر بگیرید.
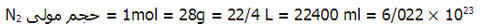
روابط استوکیومتری گازها در شرایط غیر استاندارد :(STP) دقت داشته باشید که در این صورت دیگر نمی توان حجم مولی گازها را 4/22 لیتر یا 22400 میلی لیتر در نظر گرفت، برای حل این گونه از مسائل می بایستی از چگالی گازها استفاده شود.
با استفاده از آن، جرم گاز را به حجم آن و یا بالعکس حجم گاز را به جرم گاز تبدیل می کنیم. ( توجه داشته باشید که برای تبدیل مول به حجم گاز و بالعکس می بایستی در ابتدا آن ها را به گرم تبدیل کنید. )
مرکز یادگیری سایت تبیان - تهیه و تنظیم : نوربخش

















