تغییرات برخی خاصیت های شیمیایی در جدول تناوبی

خاصیت فلزی
از بالا به پایین و از راست به چپ، خصلت فلزی در جدول تناوبی افزایش پیدا می کند.
فلزات، بزرگ ترین دسته ی عناصر را تشکیل می دهند. تمام فلزات به جز جیوه، در دمای اتاق فلز هستند و بیش تر آن ها درخشندگی نقره گون دارند. به علاوه، فلزات معمولا چکش خوار و شکل پذیر هستند و رساناهای خوب گرما و الکتریسیته اند.
آلومینیوم، کم ترین خصلت فلزی در بین فلزات را دارد و گاهی اوقات در ردیف شبه فلزات طبقه بندی می شود.
ظاهر آلومینیوم مانند فلزات است و رسانای عالی الکتریسیته است.
نافلزات
خصلت نافلزی از بالا به پایین و از چپ به راست در جدول تناوبی کاهش می یابد. 17 غیر فلز در جدول وجود دارد و در دمای اتاق، 11 تای آن ها گازی و یکی از آن ها (برم) به صورت مایع و 5 تای آن ها به صورت جامد هستند( کربن، فسفر، گوگرد، سلنیوم و ید). هیچ کدام از نافلزات، نقره گون نیستند و بیش تر به رنگ های براقند. نافلزات جامد به جای نرم و چکش خوار بودن، شکننده اند و رسانای ضعیف گرما و الکتریسیته هستند.

شبه فلزات
تعداد هفت تا از نه عنصر نزدیک مرز فلزات و غیر فلزات، شبه فلز یا نیمه رسانا هستند: بور، سیلیکون، ژرمانیوم، آرسنیک، آنتیموان، تلوریوم و استاتین. خاصیت این مواد، متوسط خاصیت های فلزات و غیرفلزات است. اکثر آن ها نقره گون هستند و در دمای اتاق، همگی جامدند؛ با این وجود، شکننده اند.
بیش تر شبه فلزات مانند سیلیکون، ژرمانیوم و آنتیموان به عنوان نیمه رسانا عمل می کنند (در دماهای پایین تر، نقش عایق و در دماهای بالاتر، نقش رسانا را دارند) و در مدارهای الکترونیکی بسیار مورد استفاده قرار می گیرند. یعنی نقش عایقی و رسانندگی شبه فلزات برخلاف فلزات است.
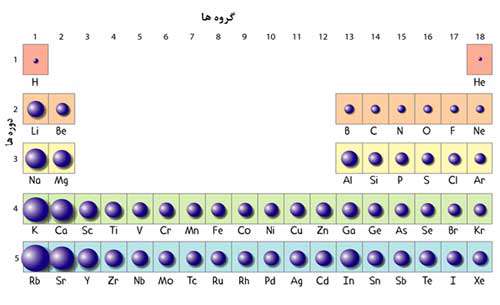
دوره ها و گروه ها
 با حرکت از چپ به راست در یک دوره، اندازهی اتمها کاهش پیدا میکند.
با حرکت از چپ به راست در یک دوره، اندازهی اتمها کاهش پیدا میکند.
 این اثر به دلیل افزایش تعداد پروتونهای هسته است؛ پس جاذبهی الکتریکی بین هستهها و الکترونهای در حال حرکت به دور آنها قویتر میشود و الکترونها را به هسته نزدیکتر میکند.
این اثر به دلیل افزایش تعداد پروتونهای هسته است؛ پس جاذبهی الکتریکی بین هستهها و الکترونهای در حال حرکت به دور آنها قویتر میشود و الکترونها را به هسته نزدیکتر میکند.
-------------------------------------

تغییرات در انرژی یونش

انرژی لازم برای برداشتن الکترون ظرفیت از یک اتم خنثی، با پتانسیل یونش تعیین می شود. بزرگ ترین مقادیر این انرژی از پایین به بالا جدول تناوبی باعث نگه داشتن محکم تر الکترون های ظرفیت اتم ها به آن ها می شود.


الکترونگاتیوی
وقتی در طول یک دوره، از چپ به راست حرکت می کنید، توانایی اتم برای جذب الکترون های دیگر افزایش می یابد. این خاصیت، ”الکترونگاتیوی” نام دارد.

میل ترکیب با الکترون
انرژی آزاد شده به هنگام اضافه کردن یک الکترون به یک اتم، الکترون خواهی نامیده می شود. از پایین به بالا و از چپ به راست افزایش پیدا می کند.

مرکز یادگیری سایت تبیان تهیه: خدیجه آلچالانلو - تنظیم: یگانه داودی

















