قانون اول ترمودینامیک
این نظر که گرما شکلی از انرژی است در سال 1839 توسط سگوئن مهندس فرانسوی و در سال 1841 توسط مایر پزشک آلمانی ارائه شد ولی هیچ گونه آزمایش تعیین کننده توسط هیچ یک انجام نگرفت. ژول از سال 1840 تا 1849 با انجام یک رشته آزمایش های تحسین برانگیز در مورد رابطه ی بین گرما و کار معادل بودن گرما و کار را ثابت کرد.
دو آزمایش متفاوت را که روی یک سیستم انجام می شود در نظر می گیریم: در یک آزمایش کار بی درروی لازم جهت تغییر حالت سیستم از 1 به 2 را اندازه می گیریم، این مقدار برابر با U2 - U1 یعنی تغییرات انرژی درونی است. در آزمایش دیگر ترتیبی می دهیم که سیستم همان تغییر را به طور با دررو طی کند و کار انجام شده را اندازه می گیریم، مسلما کار اندازه گیری شده در این آزمایش برابر با U2 - U1 نیست.
برای این که نتیجه ی حاصل با اصل بقای انرژی سازگار باشد، اجبارا باید نتیجه بگیریم که انرژی از طریقی غیر از انجام کار انتقال یافته است. این انرژی که انتقالش بین سیستم و محیط طبق اصل بقای انرژی لازم است و فقط به علت اختلاف دمای بین سیستم و محیط صورت گرفته است همان گرماست. بنابراین تعریف ترمودینامیکی گرما به صورت زیر است:
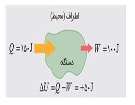
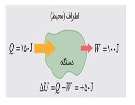
وقتی یک سیستم که محیط آن در دمایی متفاوت است، بین سیستم و محیط هم عایق گرما وجود ندارد (با دررو) و روی آن می توان کار انجام داد، دستخوش فرآیندی می شود، انرژیی که از طریق غیر مکانیکی منتقل می شود و برابر با تفاضل تغییر انرژی درونی و کار انجام گرفته شده است، گرما نامیده می شود:
(1) ( Q = U2 - U1 - ( W
(2) Q + W = U2 - U1
(3) Q + W = ∆U
این رابطه قانون اول ترمودینامیک نامیده می شود. این قانون در واقع همانقانون پایستگی انرژی است که در مورد
فرآیندهای ترمودینامیکی به کار می رود.
گرما و کاری که بین سیستم و محیط مبادله می شوند، فقط در حین فرآیند معنا دارند. در واقع می توان گفت که انتقال انرژی بین سیستم و محیط از طریق تبادل کار و گرما صورت می گیرد.
پس از اتمام فرآیند، انرژی های منتقل شده به صورت انرژی درونی سیستم در می آیند و دیگر نمی توانیم از موجودی کار یا گرما صحبت کنیم، (یعنی کار و گرما هر دو به صورت انرژی باعث تغییر انرژی درونی شده اند (معادل بودن گرما و کار) و این که هر دو صورتی از انرژی هستند؛) حتی نمی توانیم مشخص کنیم که کدام بخش از افزایش انرژی درونی در رابطه ی (3) ناشی از کار و کدام قسمت ناشی از گرما بوده است.
این موضوع را می توان به دریاچه ای تشبیه کرد که آب آن در اثر باران و وارد شدن رودها افزایش می یابد. پس از این افزایش نمی توان گفت کدام بخش از آب دریاچه از طریق رود و کدام بخش آن از طریق باران تامین شده است.
توجه: هنگامی که سیستم در حالت معینی قرار دارد که مثلا با P و T تعیین می شود، مقدار انرژی درونی U مشخص است و به این متغیرها بستگی دارد. در مورد گاز کامل می توان نشان داد که انرژی درونی فقط تابع دمای مطلق گاز است.
مرکز یادگیری سایت تبیان - تهیه : فاطمه گودرزی
تنظیم : نسیم گنجی منش