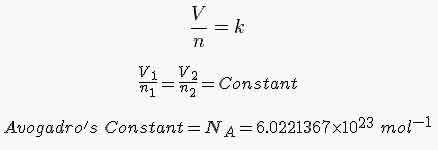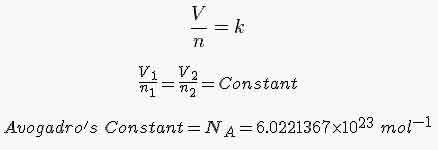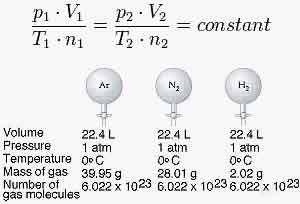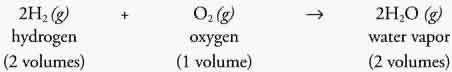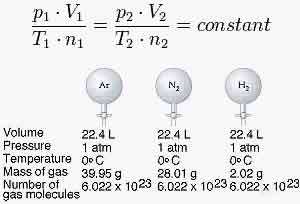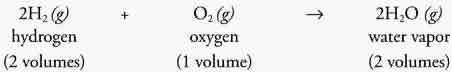روابط حجمی گازها در محاسبات استوکیومتری
قانون نسبت های ترکیبی:
در دما و فشار ثابت، گازها در نسبتهای معینی با هم واکنش می دهند.(ژوزف لوئی گلیوساک )
قانون آووگادرو:
در فشار و دمای ثابت یک مول از گازهای مختلف حجم ثابت و برابری دارند.
در دمای 0 درجه سانتیگراد (273 درجه کلوین) و فشار 1 اتمسفر (760 میلی متر جیوه)، هر مول گاز حجمی 22/4 برابر لیتر را اشغال می کند که به آن حجم مولی گازها در شرایط STP می گویند
متعارف یعنی: یعنی در فشار 1 اتمسفر و دمای 298 درجه کلوین حجم یک مول گاز، 24/45 لیتر است.
بنابراین اندازه و جرم ملکول های گاز تعیین کننده حجم گازها نیستند بلکه
این قانون با فرمول های زیر مشخص می شود:
که حاصلضرب مقدار ماده در یک ثابت حجم گاز را تعیین می کند که این ثابت، برای یک مول عدد آووگادرو است.
قانون گازهای ایده آل عبارت است از PV=nRT
واکنش تشکیل آب و شکل زیر نشان می ده د که با اینکه مولکول ها متفاوتند اما حجم ها یکسان هستند.
بنابراین تعداد اتم ها قابل شمارش است...
مثال:
یک نمونه شامل 1/5 مول نئون 8 لیتر حجم دارد. وقتی 25 گرم نئون به آن اضافه شود. حجم جدید چقدر خواهد بود ؟
بر طبق قانون اووگادرو یک مول گاز در شرایط STP دارای 22/4لیتر حجم است . بنا براین حجم 1/5 مول آن برابر خواهد بود با:
1/50 × 22/4=33/6 @ STP
اگر 1/5 مول گاز دارای حجم 8 لیتر است پس باید فشرده شده باشد و چون در شرایط STP فشار 1 atm است. بنابراین فشار برابر است با:
33/6 ÷ 8 atmospheres = 4/2 atmospheres
جرم اتمی میانگین نئون = 20.1798
25g Neon
25 ÷ 20.1798 = 1/2388 mole
پس حجم نئون در شرایط STP =
1.2388 x 22.4 = 27/75
در فشار 4/2 حجم نئون برابر است با:
27/75 ÷ 2/4 = 6/61
حجم کل:
8 + 6/61 = 14/61
مرکز یادگیری سایت تبیان
تهیه و تنظیم: یگانه داودی