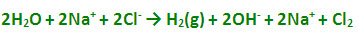سلول های الکترو شیمیایی
دید کلی
تمام واکنش های شیمیایی ، اساساً ماهیت الکتریکی دارند، زیرا الکترون ها در تمام انواع پیوندهای شیمیایی (به راه های گوناگون) دخالت دارند. اما الکتروشیمی بیش از هر چیز بررسی پدیدههای اکسایش- کاهش است. روابط بین تغییر شیمیایی و انرژی الکتریکی ، هم از لحاظ نظری و هم از لحاظ عملی حائز اهمیت است.
از واکنش های شیمیایی میتوان برای تولید انرژی الکتریکی استفاده کرد ( در سلول هایی که سلول های ولتایی یا سلول های گالوانی نامیده می شوند ) و انرژی الکتریکی را میتوان برای تبادلات شیمیایی به کار برد (در سلول های الکترولیتی).
علاوه بر این، مطالعه فرآیندهایی الکتروشیمیایی منجر به فهم پدیدههای اکسایش - کاهش میشود.
رسانش فلزی جریان الکتریکی، جاری شدن بار الکتریکی است. در فلزات، این بار به وسیله الکترون ها حمل میشود و این نوع رسانش الکتریکی ، رسانش فلزی نامیده میشود. با به کار بردن یک نیروی الکتریکی که توسط یک باتری یا هر منبع الکتریکی دیگر تامین میگردد، جریان الکتریکی حاصل میشود و برای تولید جریان الکتریکی، یک مدار کامل لازم است. تشبیه جریان الکتریسیته به جریان یک مایع، از قدیم متداول بوده است. در زمان های گذشته ، الکتریسیته بهصورت جریانی از سیال الکتریکی توصیف میشد.
قراردادهای قدیمی که سابقه آن ها ممکن است به "بنجامین فرانکلین" برسد و پیش از آن که الکترون کشف شود، مورد پذیرش بوده است، او بار مثبتی به این جریان نسبت میدهد. ما مدارهای الکتریکی را با حرکت الکترون ها توجیه خواهیم کرد. اما باید به خاطر داشت که جریان الکتریکی بنا به قرارداد به طور اختیاری مثبت و به صورتی که در جهت مخالف جاری میشود، توصیف میگردد.
جریان الکتریکی برحسب آمپر (A) و بار الکتریکی برحسب (C) کولن اندازه گیری میشود. کولن، مقدار الکتریسیته است که در یک ثانیه با جریان 1 آمپر از نقطهای میگذرد: 1C = 1A.S و 1A = 1C/S .
جریان با اختلاف پتانسیل الکتریکی که بر حسب ولت اندازه گیری میشود، در مدار جاری میشود. یک ولت برابر یک ژول بر کولن است. 1V = 1J/C یا 1V.C = 1J.
یک ولت لازم است تا یک آمپر جریان از مقاومت یک اهم بگذرد. I = V / R یا V = IR
رسانش الکترولیتی، هنگامی صورت میگیرد که یون های الکترولیت بتوانند آزادانه حرکت کنند، چون در این مورد ، یون ها هستند که بار الکتریکی را حمل میکنند. به همین دلیل است که رسانش الکترولیتی، اساساً توسط نمک های مذاب و محلول های آبی الکترولیت ها صورت میگیرد. علاوه بر این، برای تداوم جریان در یک رسانای الکترولیتی لازم است که حرکت یون ها با تغییر شیمیایی همراه باشد. منبع جریان در یک سلول الکترولیتی ، الکترون ها را به الکترود سمت چپ میراند.
بنابراین میتوان گفت که این الکترود، بار منفی پیدا میکند. این الکترون ها از الکترود مثبت سمت راست کشیده میشوند. در میدان الکتریکی که بدین ترتیب به وجود میآید، یون های مثبت یا کاتیون ها به طرف قطب منفی یا کاتد و یون های منفی یا آنیون ها به طرف قطب مثبت یا آند جذب میشوند. در رسانش الکترولیتی، بار الکتریکی به وسیله کاتیون ها به طرف کاتد و به وسیله آنیون ها که در جهت عکس به طرف آند حرکت میکنند، حمل میشود.
برای این که یک مدار کامل حاصل شود، حرکت یون ها باید با واکنش های الکترودی همراه باشد. در کاتد، اجزای شیمیایی معینی (که لازم نیست حتما حامل بار باشند) باید الکترون ها را بپذیرند و کاهیده شوند و در آند، الکترون ها باید از اجزای شیمیایی معینی جدا شده ، در نتیجه آن ، اجزا اکسید شوند. الکترون ها از منبع جریان خارج شده ، به طرف کاتد رانده میشوند.
عوامل موثر بر رسانش الکترولیتی
رسانش الکترولیتی به تحرک یون ها مربوط میشود و هر چند که این یون ها را از حرکت باز دارد، موجب ایجاد مقاومت در برابر جریان میشود. عواملی که بر رسانش الکترولیتی محلول های الکترولیت اثر دارند، عبارتند از : جاذبه بین یونی ، حلال پوشی یون ها و گرانروی حلال. انرژی جنبشی متوسط یون های ماده حل شده با افزایش دما زیاد میشود و بنابراین مقاومت رساناهای الکترولیتی ، به طور کلی با افزایش دما کاهش مییابد. یعنی رسانایی زیاد میشود. بهعلاوه ، اثر هر یک از سه عامل مذکور با زیاد شدن دما کم میشود. الکترولیز (برقکافت) الکترولیز یا برقکافت سدیم کلرید مذاب ، یک منبع صنعتی تهیه فلز سدیم و گاز کلر است. روش های مشابهی برای تهیه دیگر فلزات فعال، مانند پتاسیم و کلسیم به کار میروند. اما چنانکه بعضی از محلول های آبی را برقکافت کنیم، آب به جای یون های حاصل از ماده حل شده در واکنش های الکترودی دخالت میکند. از این رو ، یون های حامل جریان لزوماً بار خود را در الکترودها خالی نمیکنند. مثلاً در برقکافت محلول آبی سدیم سولفات ، یون های سدیم به طرف کاتد و یون های سولفات به طرف آند حرکت میکنند، اما بار این هر دو یون با اشکال تخلیه میشود.
بدین معنی که وقتی عمل برقکافت بین دو الکترود بیاثر در جریان است، در کاتد ، گاز هیدروژن بوجود میآید و محلول پیرامون الکترود ، قلیایی میشود: 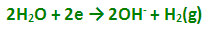
یعنی در کاتد ، کاهش صورت میگیرد، ولی به جای کاهش سدیم ، آب کاهیده میشود. به طور کلی ، هرگاه کاهش کاتیون ماده حل شده مشکل باشد، کاهش آب صورت میگیرد. اکسایش در آند صورت میگیرد و در برقکافت محلول آبی Na2SO4، آنیون ها (SO42-) که به طرف آند مهاجرت میکنند، بهسختی اکسید میشوند: 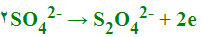
بنابراین ترجیهاً اکسایش آب صورت میگیرد: 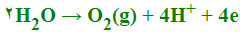
یعنی در آند ، تولید گاز اکسیژن مشاهده میشود و محلول پیرامون این قطب ، اسیدی میشود. به طور کلی هرگاه اکسایش آنیون ماده حل شده مشکل باشد، آب در آند اکسید میشود.
در الکترولیز محلول آبی NaCl ، در آند، یون های Cl- اکسید میشوند و گاز Cl2 آزاد میکنند و در کاتد ، احیای آب صورت میگیرد. این فرآیند ، منبع صنعتی برای گاز هیدروژن ، گاز کلر و سدیم هیدروکسید است:
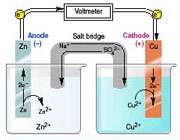
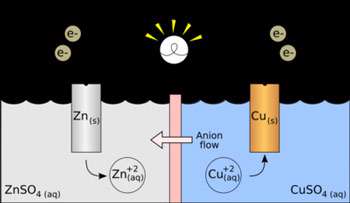
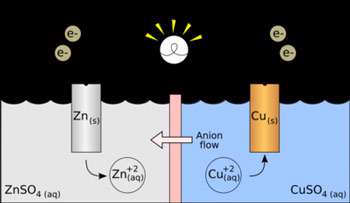
سلول های ولتایی سلولی که بهعنوان منبع انرژی الکتریکی به کار میرود، یک سلول ولتایی یا یک سلول گالوانی نامیده میشود که از نام "آلساندرو ولتا" (1800) و "لوئیجی گالوانی" (1780) ، نخستین کسانی که تبدیل انرژی شیمیایی به انرژی الکتریکی را مورد آزمایش قرار دادند، گرفته شده است. واکنش بین فلز روی و یون های مس II در یک محلول ، نمایانگر تغییری خود به خود است که در جریان آن ، الکترون منتقل میشود.
پایگاه بزرگترین بانک اطلاعات مواد شیمیایی ایران
مرکز یادگیری سایت تبیان - تجمیع و تنظیم : نوربخش