قدرت اسیدها و بازها
در این مطلب می خواهیم بدانیم به طور کلی، قدرت اسیدها و بازها چگونه تعیین می شود و این موضوع چه تأثثیری در انجام واکنش ها و نتایج آن ها دارد.
خواص عمومی اسیدها:
- با فلزات واکنش می دهند.
- دارای pH پایینی هستند.
- زمانی که فنل فتالئین ( یک شاخص برای تعیین اسید و باز ) در حین تیتراسیون به محلول اسیدی اضافه می شود، محلول شفاف باقی می ماند.
*** تیتراسیون، فرایندی شیمیایی است که مقدار مشخصی از ماده ی اصلی نمونه ی حل شده با افزودن مقدار دقیق و مشخص از یک ماده ی حل شده ی دیگری معین می شود. محلول با غلظت معلوم به تدریج به محلولی که ناشناخته است، اضافه می شود( این کار با استفاده از یک بورت انجام می گیرد که یک لوله آزمایش دراز با دریچه ای در انتهای خود است ). این کار تا زمانی انجام می گیرد که به نقطه ی هم ارزی (نقطه ی پایان) برسد. مقدار ماده ی ناشناخته در این حالت می تواند محاسبه شود. نقطه ی هم ارزی با تغییر خاصی معین می شود. به عنوان مثال، از رنگ ماده ی شاخص مانند لیتموس یا خاصیت الکتریکی.
چه عاملی باعث ضعف یا قدرت اسیدها می شود؟
اسید قوی، اسیدی است که به آسانی تجزیه شود تا یون های هیدروژن تشکیل دهد. اسید ضعیف به راحتی نمی تواند تجزیه شود؛ بنابراین نمی تواند یون های هیدروژن را به راحتی تشکیل دهد.
پس عامل قدرت اسیدها تجزیه ی آسان و رها کردن یون هیدروژن است.
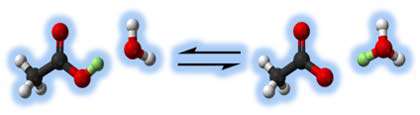
اسیدهایی مانند اسید استیک (HC2H3O2)، اسید هیدروفلوئوریک (HF)، اسید نیتروس ( اسیدی ناپایدار که فقط در محلول و به شکل نمک های نیترات شناسایی می شود( HNO2 ) جزو اسیدهای ضعیف هستند.
در شکل زیر تجزیه ی اسید استیک را مشاهده می کنید.
اسیدهایی مانند اسید هیدروکلریک (HCl)، اسید سولفوریک (H2SO4) و اسید نیتریک (HNO3) اسیدهایی قوی هستند.
خواص عمومی بازها:
- الکترولیت هستند.
- سطح pH آن ها بالاست.
- زمانی که فنل فتالئین در هنگام تیتراسیون به محلول بازی اضافه شود، رنگ محلول، صورتی خواهد شد.
چه عاملی باعث ضعف یا قدرت بازها می شود؟
همانند یک اسید قوی، باز قوی به راحتی تجزیه می شود و یون های هیدروکسید تشکیل می دهد نه هیدرونیوم. باز ضعیف نمی تواند یه راحتی تجزیه شود؛ بنابراین نمی تواند به آسانی یون های هیدروکسید تولید کند.
پس عامل قدرت بازها تجزیه ی آسان و رها کردن یون هیدروکسید است.
بازهایی مانند آمونیاک (NH3)، یون فسفات ( -PO4) و آب (H2O) ضعیف هستند.
بازهایی مانند هیدروکسید سدیم (NaOH)، هیدروکسید پتاسیم (KOH) و اکسید کلسیم (CaO) بازهایی قوی هستند.
در شکل زیر مثالی از انتقال پروتون را می بینید:
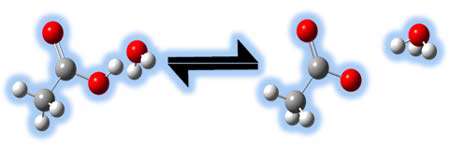
استفاده از مفهوم جفت های مزدوج اسید و باز به ما اجازه می دهد تا نظر خود را راجع به قدرت نسبی اسیدها و بازها به راحتی بیان کنیم.
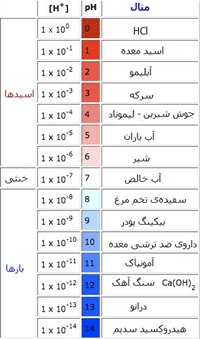
در جدول زیر غلظت یون هیدروژن و سطح pH را برای برخی مواد می بینیم:
منظور از درانو (Drano) نوعی ماده است که برای تمیزی و باز کردن لوله ها و فاضلاب به کار می رود.
در جدول زیر نیز افزایش قدرت برخی اسیدها و بازها را مشاهده می کنید:
در ضمن، اسید و باز مزدوج هر کدام از مواد نیز در کنار آن نوشته شده است.
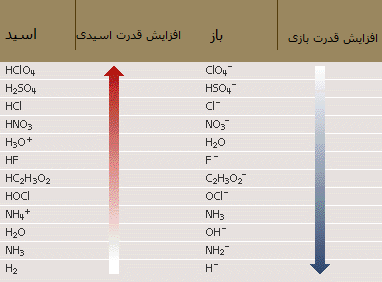
از طرف دیگر، واژه ی قوی یا ضعیف برای اسیدها و بازها به معنای توانایی آن ها برای هدایت جریان الکتریسیته است. اگر اسید یا باز قوی است، الکتریسیته را به طور قوی هدایت می کند و بالعکس.
اثبات تجربی رسانندگی اسید و باز:
با استفاده از یک لامپ و یک مدار ساده می توان این مطلب را به خوبی درک کرد. این مدار با محلولی که شامل مقادیر زیادی یون است، کامل خواهد شد. اگر از اسیدی مانند HCl در محلول هدایت جریان الکتریسیته استفاده شود، لامپ بسیار پرنور روشن خواهد شد. اگر مدار با محلولی که شامل هیچ یونی نیست یا تعداد کمی یون دارد، کامل شود، محلول مورد نظر الکتریسیته را هدایت نخواهد کرد یا به طور ضعیف رسانای جریان الکتریسیته خواهد بود. به عنوان مثال، اسید استیک باعث این ضعف می شود.
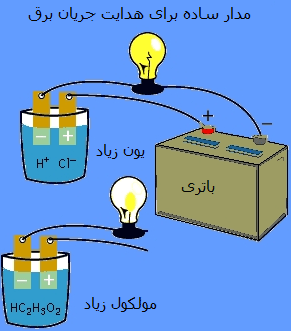
اصل رسانایی:
اسید یا بازی که جریان الکتریسیته را به طور قوی هدایت می کند، شامل مقادیر زیادی یون است و اسید یا باز قوی نامیده می شود.
قدرت پیوندی:
قدرت پیوندی اسیدها و بازها توسط مقادیر نسبی یون ها یا مولکول های آن ها در محلول معین می شود. پیوندها به صورت زیر نشان داده می شوند:
باز اسید
H-A M-OH
که A یون منفی است و M یون مثبت است. اسیدهای قوی، یون های زیاد در محلول دارند؛ بنابراین پیوندهایی که H و A را متصل به هم نگه می دارند، باید ضعیف باشند. یعنی اسیدهای قوی به آسانی به یون های خود تجزیه می شوند.
اسیدهای ضعیف، بیش تر در محلول مولکول رها می کنند و تعداد یون های آن ها در محلول کم تر است؛ بنابراین پیوندهای نگه دارنده ی H و A باید قوی باشند. اسیدهای ضعیف به راحتی نمی توانند به یون های خود تجزیه شوند اما مولکول های آن ها متصل به هم باقی می ماند.
مرکز یادگیری سایت تبیان - تهیه : خدیجه آلچالانلو
تنظیم: نوربخش