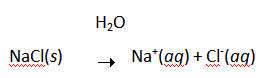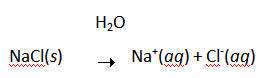الکترون خواهي
همان گونه که مي دانيم، انرژي يونش، تمايل يک اتم خنثي براي مخالفت با از دست دادن الکترون را اندازه مي گيرد. يعني گرفتن يک الکترون از اتم، مستلزم صرف انرژي است (اين فرايند، گرماگير است). براي مثال، برداشتن يک الکترون از اتم فلوئور خنثي و تشکيل يون با بار مثبت، مقدار قابل ملاحظه اي انرژي لازم دارد:
الکترون خواهي يک عنصر، مقدار انرژي خارج شده از آن است که در طول اين فرايند، يک اتم خنثي در فاز گازي، يک الکترون اضافي به دست مي آورد تا يون با بار منفي تشکيل دهد. براي مثال، زماني که اتم فلوئور در حالت گازي، الکترون به دست مي آورد تا يون منفي فلوئور تشکيل دهد، انرژي آزاد مي کند (تشکيل اين پيوند بين اتم فلوئور و الکترون خارجي، گرماده است):
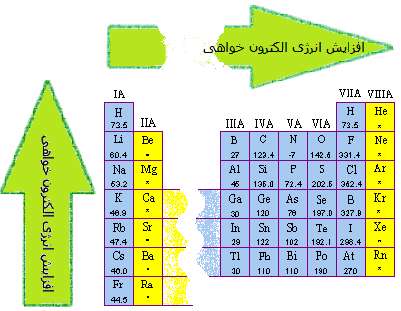
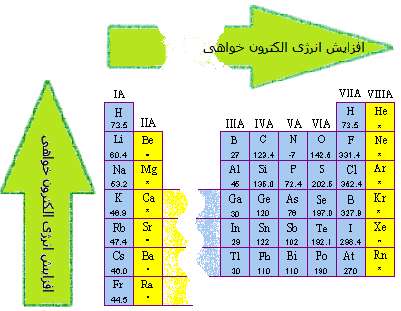
اندازه گيري الکترون خواهي، مشکل تر از انرژي يونش است و معمولاً با ارقام با معني کم تري شناسايي مي شود. الکترون خواهي عناصر گروه هاي اصلي جدول تناوبي در شکل 1 نشان داده شده است. مي توان از اين شکل، اطلاعات زير را فهميد:
• به طور کلي، الکترون خواهي به دو دليل زير از بالا به پايين در هر ستون جدول تناوبي، کوچک تر مي شود؛ نخست، الکترون اضافه شده به اتم در اوربيتال هاي بزرگ تر جاي مي گيرد و زمان کم تري در اطراف هسته ي اتم صرف مي کند. دوم اين که تعداد الکترون هاي عناصر از بالا به پايين جدول تناوبي در هر ستون افزايش پيدا مي کند، بنابراين نيروي پس زني و دافعه بين الکترون اضافه شده و الکترون هاي موجود در اتم خنثي، بيش تر مي شود.
• به دليل اين که دافعه بين الکترون اضافه شده و الکترون هاي متعلق به اتم خنثي به حجم اتم بستگي دارد، داده هاي الکترون خواهي پيچيده تر مي شوند. در ميان نافلزات گروه هاي 6 و 7 اصلي، اين دافعه براي کوچک ترين اتم هاي دو ستون ياد شده (اکسيژن و فلوئور)، بزرگ ترين مقدار را دارد؛ بنابراين الکترون خواهي اين عناصر، کوچک تر از عناصر زيري آن ها در اين دو ستون است. اما به هر صورت، الکترون خواهي از بالا به پايين در حال کاهش است.
شکل 1: روندکلي تغييرات الکترون خواهي در جدول تناوبي
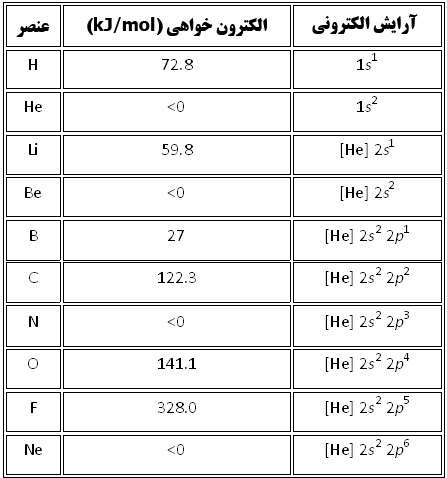
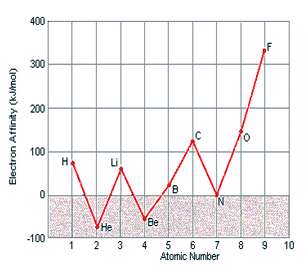
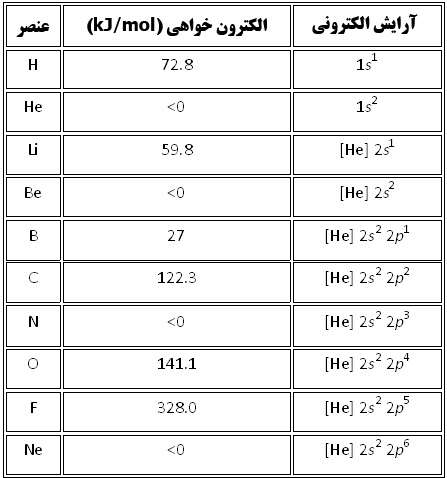
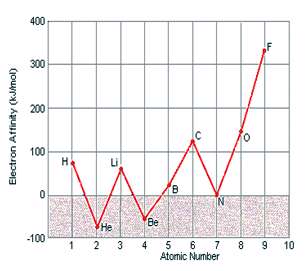
در داده هاي زير، هيچ الگوي خاصي در طول رديف هاي جدول تناوبي ديده نمي شود اما اين داده ها به همراه آرايش الکتروني اين عناصر، مفهوم پيدا مي کنند. در نتيجه، عناصري مانند هليوم، بريليوم، نيتروژن و نئون که آرايش الکتروني پايدار دارند، کشش کمي براي جذب الکترون اضافي دارند و زماني که اتم خنثي اين عناصر، الکترون اضافي به دست مي آورد، هيچ انرژي از خود آزاد نمي کنند.
آرايش اين عناصر چنان پايدار است که وادار کردن آن ها براي به دست آوردن الکترون اضافي و تشکيل يون منفي، واقعاً انرژي مي گيرد.
آرايش الکتروني و الکترون خواهي ده عنصر ابتدايي جدول تناوبي به همراه شکل آن ها.
نتايج اندازه ي نسبي الکترون خواهي و انرژي يونش
اغلب تصور مي شود که سديم با کلر واکنش مي دهد تا يون هاي Na+ و Cl- تشکيل دهند زيرا اتم هاي کلر بيش تر از اتم هاي سديم، الکترو ن ها را "دوست دارند". شکي نيست که سديم به شدت با کلر واکنش مي دهد تا NaCl تشکيل دهد:
از اين گذشته، راحت حل شدن NaCl در آب که باعث هدايت الکتريسيته مي شود، گواه اين واقعيت است که محصول اين واکنش، يک نمک است و شامل يون هاي Na+ و Cl- است:
تنها سؤال مطرح شده در اين قسمت، اين است که آيا فرض الکترون دوست بودن اتم هاي کلر نسبت به اتم هاي سديم، جايز است؟
اولين انرژي يونش سديم 5/1 برابر بزرگ تر از الکترون خواهي کلر است:
بنابراين، برداشتن الکترون از اتم سديم خنثي، از الکترون به دست آوردن اتم کلر خنثي انرژي بيش تري مي گيرد و از اين خصلت کلر تأمين مي شود.
مرکزيادگيري سايت تبيان - تهيه: خديجه آلچالانلو
تنظيم: مريم فروزان کيا