پیوندهای شیمیایی
می دانیم اتم ها اجزای سازنده ی تمام مواد هستند و از طریق پیوندهای شیمیایی ناشی از نیروهای جاذبه ی قوی که بین آن ها وجود دارد، به هم دیگر اتصال پیدا می کنند. اما دقیقاً یک پیوند شیمیایی چیست؟
ناحیه ای که هنگام برهم کنش الکترون های اتم های مختلف با یکدیگر ایجاد می شود، پیوند شیمیایی نامیده می شود. الکترون هایی که در پیوند شیمیایی شرکت می کنند، الکترون های ظرفیت نامیده می شوند که در خارجی ترین پوسته اتم یافت می شوند.
زمانی که دو اتم به هم دیگر نزدیک می شوند، الکترون های خارجی ترین لایه ی هر دو با هم اندرکنش می کنند. با این که الکترون ها هم دیگر را دفع می کنند،اما باعث جذب پروتون های درون اتم مقابل خود می شوند. اثر متقابل نیروها در اتم ها باعث تشکیل پیوند بین آن ها و اتصالشان به هم دیگر خواهد شد.
همان گونه که از اطلاعات اولیه ی شیمی می دانیم، عناصر گازی بی اثر گروه 8 به صورت گازهای تک اتمی وجود دارند و در حالت کلی با دیگر عناصر واکنش نمی دهند. در مقابل، دیگر عناصر گازی به صورت مولکول های دو اتمی وجود دارند (H2, N2, O2, F2, Cl2) و همگی به جز نیتروژن، واکنش پذیر هستند. واکنش پذیری این عناصر در معادلات زیر نشان داده شده است:
2Na + Cl2 ........ 2NaCl
2H2 + O2 ......... 2H2O
C + O2 .......... CO2
C + 2F2 .......... CF4
اکنون سؤال این است که چرا اتم های بسیاری از عناصر با هم واکنش نشان می دهند تا مولکول های پایداری به وجود آورند؟
برای پاسخ به این سؤال، ابتدا بهتر است با یک مدل بسیار ساده برای جذب یا پیوند اتم ها به یکدیگر شروع کنیم و سپس به توضیحات سطح بالا برسیم.
دو نوع اصلی پیوند بین اتم ها، پیوند یونی و کوالانسی است. اما انواع دیگر پیوند هم وجود دارد.
پیوند یونی:
یک پیوند یونی زمانی تشکیل می شود که اتمی، یک یا چند الکترون ظرفیت خود را به اتم دیگری ببخشد یا همین الکترون ها را از این اتم بپذیرد.
به عنوان مثال، زمانی که سدیم در محیطی که دارای گاز کلر است، سوزانده شود، ترکیب سدیم کلراید تولید می کند(معادله ی اول). این ترکیب، نقطه ی ذوب بالایی دارد (800° C) و در آب حل می شود تا یک محلول رسانا حاصل کند.
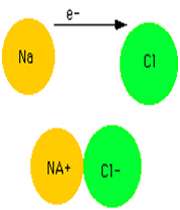
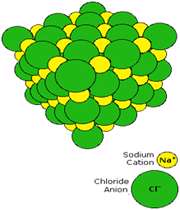
سدیم کلراید یک ترکیب یونی است. در شکل 1 (الف و ب)،تشکیل پیوند سدیم کلراید و نوع پیوند آن ها را مشاهده می کنید. ساختار جامد کریستالی سدیم کلراید به صورت ج است.
 (ب) |
(الف) |
(ج)
شکل 1: پیوند یونی سدیم کلراید.
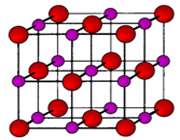
انتقال تنها الکترون 3s اتم سدیم به اوربیتال نیمه پر 3p اتم کلر، کاتیون سدیم (لایه ی ظرفیت این یون مثبت،مانند آرایش نئون است) و آنیون کلر (لایه ی ظرفیت این یون منفی،مانند آرایش آرگون است) تولید می کند. جاذبه ی الکتروستاتیکی منجر می شود یون های با بارمخالف در یک شبکه ی بلوری (شکل 1- ج) به هم فشرده شده و روی هم انباشته شوند (شکل 2).
نیروهای جاذبه ای که این یون ها را در محل خود، متصل به هم نگه می دارند، می توانند به عنوان پیوند های یونی شناخته شوند.
شکل 2: انباشتگی یون های منفی و مثبت کلر و سدیم در سدیم کلراید.
پیوند کوالانسی:
در 3 واکنش دیگر معادلات بالا، محصولاتی تولید می شود که بسیار متفاوت با سدیم کلراید هستند. آب در دمای اتاق، مایع است و دی اکسیدکربن و تترافلوئورید کربن،گاز هستند. این ترکیبات از یون تشکیل نشده اند.
یک اندرکنش متفاوت بین اتم ها، پیوند کوالانسی نامیده می شود که با اشتراک الکترون های والانس (ظرفیت) اتم ها به جای انتقال آشکار الکترون در پیوند یونی، اتفاق می افتد. شباهت های خواص فیزیکی عناصر دو اتمی H2، N2، O2، F2 و Cl2 (همگی به صورت گاز هستند) پیشنهاد می کند که پیوند کوالانسی هم داشته باشند.
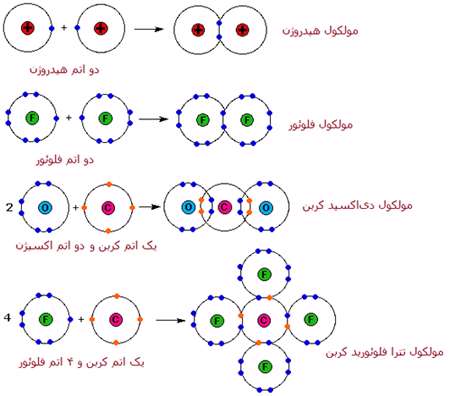
انواع پیوندهای کوالانسی معادلات بالا
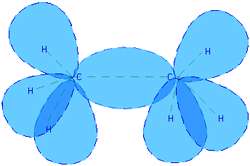
شکل 3: پیوند کوالانسی در مولکول اتان.
لازمه ی پیوند کوالانسی این است که ترازهای انرژی یا لایه های بیرونی تر اتم ها به طور کامل پر نشده باشند تا الکترون های این اتم ها کاملاً بین آن ها به اشتراک گذاشته شوند. در الماس، اتم های کربن پیوندهای کوالانسی با یکدیگر تشکیل می دهند. پیوند کوالانسی، پیوندی بسیار قوی است.
پیوند کوالانسی قطبی:
این پیوندها بین پیوندهای یونی و کوالانسی قرار می گیرند. در این پیوند، اتم ها الکترون هایشان را به اشتراک می گذارند اما الکترون ها بیش تر وقت خود را در اطراف اتمی با مقدار الکترونگاتیوی بزرگ تر می گذرانند. بهترین مثال این پیوند،
مولکول آب است. اکسیژن بسیار الکترونگاتیوتر از هیدروژن است؛ بنابراین الکترون های شرکت کننده در پیوند قطبی آب، بیش تر وقت خود را سمت اکسیژن سپری می کنند.
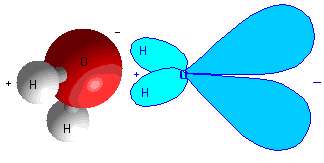
شکل 4: مولکول قطبی آب.
 پیوند هیدروژنی:
پیوند هیدروژنی:
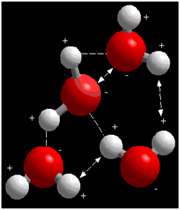
در مولکول آب، این موضوع که اکسیژن به طور منفی و هیدروژن به طور مثبت باردار شده، به این معناست که هیدروژن های یک مولکول آب، اکسیژن های همسایه ی خود را جذب می کنند و برعکس.
زیرا بار هر دو مخالف هم است. این جاذبه ی بزرگ الکتروستاتیکی، پیوند هیدروژنی نامیده می شود و در تعیین بسیاری از خواص آب نقش دارد. مولکول آب می تواند این نوع پیوند را با مولکول های قطبی یا یون های دیگری مانند هیدروژن یا سدیم تشکیل دهد.
علاوه بر این، پیوندهای هیدروژنی می توانند درون و بین دیگر مولکول ها نیز اتفاق بیفتند. برای مثال، دو رشته مولکول DNA با پیوند هیدروژنی به هم دیگر اتصال پیدا می کنند.
شکل فوق، گروه کوچکی از مولکول های آب را نشان می دهد. پیوندهای هیدروژنی بین بارهای مخالف با خط تیره نشان داده شده اند. خطوط پیکان دار دافعه ی بین بارهای مشابه را نشان می دهند. تعادل پیوندهای هیدروژنی و نیروهای دافعه در خواص ویژه ی آب نقش مهمی دارند.
پیوند دیگری که ممکن است وجود داشته باشد، پیوند فلزی است. زمانی که الکترون های دو اتم فلزی به اشتراک گذاشته شوند، پیوند فلزی تشکیل می-شود.
مرکز یادگیری سایت تبیان - تهیه: خدیجه آلچالانلو
تنظیم: مریم فروزان کیا