آرایش الکترونی

به کمک آرایش الکترونی یک اتم می توان خواص فیزیکی و شیمیایی آن عنصر را پیش بینی نمود. طبق اصل آفبا (اصل بناگذاری) الکترون ها به ترتیب افزایش انرژی در اوربیتال ها قرارمی گیرند.
اوربیتال چیست؟
ابر الکترونی اصطلاحی است که به مدل اتمی لایهای یا همان کوانتومی مربوط میشود. این مدل که کوانتومی نام دارد میگوید که مداری برای حرکت الکترون ها به دور هسته اتم وجود ندارد و الکترون ها از لایهای به لایه دیگر میروند. در بین این حرکت و تغییر لایه فوتون (انرژی به دست آمده) را به صورت نور آزاد میکنند. حال اگر محل تردد الکترونها را به صورت نقطههایی مشخّص کنیم ( که در حقیقت نمیتواند امکان پذیر باشد و در حدّ فرض است) شکلی ابر مانند به وجود خواهد آمد، به این شکل ابر الکترونی گفته میشود.
بعضی بخشهای این ابر تراکم بیشتری دارد و بعضی بخشها تراکم کمتر. به طور کلّی نزدیک هسته و خیلی دور از هسته تراکم کمتری دارند. به فضایی محدود در اطراف هسته اتم که بیشترین احتمال حضور الکترون در آن است، اوربیتال میگویند.
انواع اربیتال ها عبات است از : s,p,d,f,g

برای تعیین آرایش الکترونی اتمها، نه تنها درباره ترازهای انرژی اصول و قواعدی باید مورد توجه قرار گیرد، بلکه در هر تراز انرژی، در مورد چگونگی اشغال شدن اوربیتال ها به وسیله الکترون ها نیز اصول و قواعدی وجود دارد که باید رعایت شوند.
اعداد کوانتومی
هر الکترون را میتوان با چهار عدد کوانتومی مشخص کرد که به منزله شناسنامه الکترون هستند:
- n فاصله نسبی الکترون از هسته
این عدد نشان دهنده ترازهای انرژی است که الکترون ها در آن ترازها به دور هسته گردش میکنند و عدد صحیحی میباشد. این عدد میتواند کلیه مقادیر اعداد صحیح مثبت بجز صفر را قبول کند.
- L لایه فرعی و شکل اوربیتال
- S جهت گیری اوربیتال در فضا
- عدد کوانتومی مغناطیسی مداری

روش پر كردن اوربیتال ها:
روش آفبا
الف ) الكترون ها به ترتیب در اوربیتال هایی جای می گیرند كه كم ترین سطح انرژی را داشته باشند.
ب ) اصل طرد پاولی : هیچ دو الكترونی در اتم نمی تواند چهار عدد کوانتومی یکسان داشته باشد پس در هر اوربیتال حداكثر دو الكترون با اسپین مخالف می تواند قرار گیرد.
ج ) اصل هوند : طبق اصل هوند اوربیتال های هم انرژی هنگامی زوج می شوند که هرکدام یک الکترون داشته باشند. هنگامی که الکترون ها چند اوربیتال هم انرژی از یک تراز فرعی را در اختیار داشته باشند به نحوی پخش می شوند که بیشترین اوربیتال ها اشغال شود یعنی تا در هر اوربیتال یک الکترون جای نگیرد هیچ اوربیتالی دارای دو الکترون نمی شود .
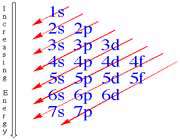
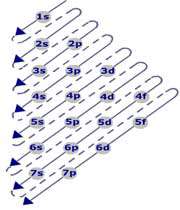
د) به طور کلی اوربیتال هایی ابتدا الکترون می پذیرند که مجموع شماره تراز اصلی و عدد سمتی کوچکتری n+l داشته باشند و چنانچه مجموع این دو عدد? در دو اوربیتال برابر باشد اوربیتالی ابتدا الکترون می پذیرد که شماره ترازاصلی انرژی در آن ( n ) کوچک تر باشد.
برای آشنایی بیشتر می توانید آزمایش زیر را انجام دهید.
دستورالعمل :
- با انتخاب Periodic Table می توانید جدول تناوبی را مشاهده کنید که البته در این جا با حرکت دادن ماوس بر روی هر کدام از عناصر جدول جزئیات مربوط به آن عنصر به نمایش در خواهد آمد. در این جا با کلیک بر روی Groups و انتخاب هر کدام از گزینه ها، گروه های مختلف جدول تناوبی و جایگاه آن ها در جدول مشخص می شود که با رنگ سبز نمایان می گردد.
- با انتخاب Electron Configuration آرایش الکترونی هر کدام از عناصر مورد بررسی قرار می گیرد که با کلیک بر روی Next و Previous می توانید عناصر قبلی و بعدی را جایگزین نمایید یا با حرکت دادن ماوس بر روی جدول ارائه شده عنصر مورد نظر را انتخاب کنید.
- با انتخاب Plot Data ، اطلاعات به صورت نمودار نمایش داده می شود که این اطلاعات می تواند بر حسب خواص عناصر
( properties ) و یا گروه های جدول ( Groups ) تنظیم گردد.
مثال :
3s : n+l = 3+ 0= 3
3P : n+l = 3+ 1= 4
3d : n+l = 3+ 2= 5
4s : n+l = 4+ 0= 4
4P : n+l = 4+ 1=5
آرایش الکترونی و نحوه چینش الکترون ها در اوربیتال های اطراف هسته اتم و شیوه پر شدن زیر لایهها به ترتیب زیر است :
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
مرکز یادگیری سایت تبیان
تهیه و تنظیم : طیبه موسیوند