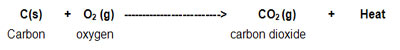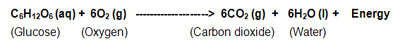واکنش های گرماده و گرماگیر
مقدمه:
دو نوع واکنش که بر اساس تغییرات گرما صورت می پذیرند به نام های واکنش های گرماده و گرماگیر می باشند.
واکنش های گرماده:
آن دسته از واکنش هایی که در آن ها گرما تولید می شود را واکنش های گرماده می گویند.
مثال:
1) زمانی که کربن در اکسیژن برای تشکیل کربن دی اکسید می سوزد، مقادیر زیادی گرما تولید می کند.
بنابراین سوختن کربن در اکسیژن به جهت تولید گرما، یک واکنش گرماده می باشد. در یک واکنش گرماده، گرمادهی واکنش به صورت نوشتن " Heat +" یا " Heat energy + " ( انرژی گرمایی ) و یا فقط " Energy + " در طرف محصولات معادله ی واکنش، مشخص می شود.
2) تنفس نیز مثالی از واکنش گرماده است. زیرا در طی این فرآیند، انرژی تولید می شود. در واقع در فرآیند تنفس، گلوکز با اکسیژن در سلول های بدن ما ترکیب می شود و در نهایت دی اکسید کربن و آب به همراه مقادیری انرژی گرمایی تولید می کند.
واکنش های گرماگیر:
آن دسته از واکنش هایی که برای انجام آن ها گرما جذب می شود، به عنوان واکنش های گرماگیر تعریف می شوند.
مثال:
1) زمانی که نیتروژن و اکسیژن در یک دمای خیلی بالایی (در حدود 3000oC ) برای تشکیل نیتروژن مونوکسید ترکیب می شوند، مقادیر زیادی گرما برای این واکنش جذب می کنند.
بنابراین واکنش بین نیتروژن و اکسیژن که منجر به تشکیل نیتروژن مونوکسید می شود، به دلیل جذب گرما جزء واکنش های گرماگیر محسوب می شود. یک واکنش گرماگیر معمولا با نوشتن " Heat +" یا " Heat energy +" و یا فقط
" Energy + " در طرف واکنش گرهای یک معادله ی واکنشی، مشخص می شود.
2) تمام واکنش های تجزیه ای برای انجام شدن نیاز به کسب انرژی ( به صورت نور، گرما یا الکتریسیته ) دارند. برای مثال، زمانی که به کلسیم کربنات گرما داده می شود، این ماده به کلسیم اکسید و کربن دی اکسید تجزیه می شود.
جهت یادگیری بیشتر آزمایش زیر را انجام دهید.
دستورالعمل:
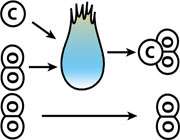
در ابتدا توضیحاتی در مورد انرژی فعالسازی داده می شود. برای این که واکنش ها انجام بگیرند، مولکول های واکنش دهنده بایستی با یکدیگر برخورد کنند. فقط برخورد این مولکول هاست که منجر به تشکیل محصولاتی با سطح انرژی بیشتر و یا کم تر از انرژی واکنش دهنده ها می شود. بنابراین مقدار انرژی لازم برای انجام یک واکنش ( چه در واکنش رفت و چه در برگشت ) را انرژی اکتیواسیون یا فعالسازی می گویند. در واقع انرژی فعالسازی شرط انجام واکنش است و یا کم ترین مقدار انرژی ای است که یک برخورد باید فراهم کند تا واکنش انجام شود.
سپس با کلیک بر روی Exothermic Reaction توضیحاتی در مورد انجام واکنش گرماده داده می شود. در این جا واکنش NO2 با CO که جزء واکنش گرهای واکنش هستند، مورد بررسی قرار می گیرد.
کلیک بر روی A : در ابتدا NO2 و CO بایستی یک برخورد کارا و مؤثر داشته باشند. برخوردی که در جهت مناسب و با انرژی کافی صورت گیرد.
کلیک بر روی B : نشان داده می شود که در این مرحله کمپلکس فعال با دارا بودن انرژی فعالسازی ای معادل 132 کیلو ژول بر مول تشکیل می شود. در واقع کمپلکس فعال به ترکیبی گفته می شود که دارای بیشترین انرژی در طی واکنش شیمیایی است. کمپلکس فعال به عنوان یک واسط بین واکنش گرها و محصول عمل می کند. دراین جا پیوند بین NO2 و CO ، مولکولی ناپایدار را تولید می کند.
کلیک بر روی C : در این مرحله پیوند بین نیتروژن واکسیژن متصل به کربن، سست می شود.
کلیک بر روی D : و در این جا محصول نهایی ( CO2 و NO ) با شکستن پیوند به طور کلی، تولید می شود.
با کلیک بر روی Endothermic Reaction ، توضیحاتی در مورد واکنش گرماگیر داده می شود. در این قسمت واکنش NO با Cl2 برای تشکیل NOCl و Cl مورد بحث قرار می گیرد. در این واکنش هم، قسمت های مختلف D، C، B، A برای شرح واکنش می باشند. در هر دو واکنش میزان آنتالپی واکنش نیز منظور شده است. آنتالپی با انرژی درونی مرتبط است و تغییرات انرژی را نشان می دهد که در واکنش های گرماگیر مثبت و در واکنش های گرمازا منفی است.