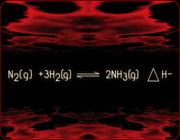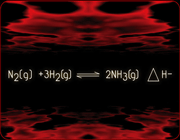اثر دما بر روی تعادل
حالت تعادلی در هر سیستمی به وجود فاکتورهایی در آن سیستم بستگی دارد. مثل دما، فشار و غلظت گونه های مختلف. این فاکتورها، متغیرها و یا پارامترهای واکنش نامیده می شوند. تغییر در هر کدام یک از این پارامتر ها می تواند بر روی موقعیت تعادل تأثیر گذار باشد. قاعده ی کلی که می تواند اثر تغییرات در این پارامتر ها را بر روی حالت تعادلی توضیح دهد، در سال 1885 توسط اچ لوشاتلیه ( H.Le Chatelie ) و اف براوون ( F.Braun ) در سال 1886، فرمول بندی شد. اما به طور معمول این قاعده به نام اصل لوشاتلیه نامیده می گردد.
این اصل بدین صورت بیان می گردد که اگر یک سیستم در حالت تعادل در معرض تغییر در یک یا متغیرهای بیشتری نظیر فشار، دما و یا غلظت قرار گیرد، تعادل در مسیری جابه جا می شود که اثر آن تغییر را خنثی کند. اصل لوشاتلیه، اصل تعادل متحرک و یا سیار نیز نامیده می شود. زمانی که اثر تغییر اعمال شده بر روی سیستم، روی تعادل همان سیستم اثر می گذارد، می توان نشان داد که اصل لوشاتلیه نیز می تواند در پیشگویی مراحل واکنش به شکل کیفی مفید واقع شود.
اثر تغییر دما:
بر طبق اصل لوشاتلیه، زمانی که دما یا گرمای موجود در سیستم در حالت تعادل افزایش می یابد، سیستم بایستی در مسیری حرکت کند تا گرمای افزوده شده را به طور کامل تحلیل برد ( خنثی کردن اثر افزایش دما ).
بنابراین افزایش دمای یک سیستم شیمیایی در حالت تعادل، یک واکنش گرماگیر را نشان می دهد. یعنی واکنشی که با جذب گرما، انجام می شود. از طرف دیگر، اگر دمای سیستم تحت شرایط فشار و حجم ثابت کاهش یابد، تعادل در جهتی جا به جا خواهد شد که منجر به تولید مقداری گرما شود. کاهش در دمای یک سیستم در حالت تعادل، یک واکنش گرماده را نشان می دهد یعنی واکنشی که در ضمن آن گرما از دست می رود. برای مثال واکنش زیر را بررسی می کنیم.
واکنش در مسیر رفت (رو به جلو) گرماده و در مسیر برگشت (رو به عقب) گرما گیر می باشد. اگر دمای سیستم تعادلی افزایش یابد، بر طبق اصل لوشاتلیه تعادل در جهتی جا به جا خواهد شد که اثر دمای اعمال شده را خنثی کند یعنی واکنش گرماگیر صورت می گیرد و تعادل به سمت چپ (واکنش گرها) جا به جا می شود. در واقع در این جا مقداری از آمونیاک تجزیه می شود. از طرف دیگر زمانی که دمای سیستم تعادل کاهش می یابد، واکنش گرماده صورت می گیرد. یعنی تعادل در جهتی جا به جا خواهد شد که گرمای از دست رفته را تولید کند. بنابراین واکنش به سمت رفت و یا به سمت راست (تولید آمونیاک) جا به جا خواهد شد.
بنابراین می توان نتیجه را به صورت زیر نشان داد:
افزایش دما تعادل را به سمت واکنش گرماگیر و کاهش دما، تعادل را به سمت واکنش گرماده جا به جا می کند.
بررسی قابلیت حل شدن نسبت به دما:
در مورد موادی که انحلال آنها گرماده است با افزایش دما قابلیت حل شدن کاهش می یابد در نتیجه حرکت نمودار نزولی خواهد بود اما در مورد موادی که انحلال آنها گرماگیر است با افزایش دما قابلیت حل شدن افزایش می یابد لذا حرکت نمودار صعودی خواهد بود. در مورد NaCl و NaBr نیز با افزایش دما تغییر چندانی در قابلیت حل شدن ایجاد نمی شود لذا حرکت نمودار در مورد این دو نمک تقریباً به صورت افقی است.
جهت یادگیری بیشتر می توانید در این جا کلیک کنید.
در فیلم مزبور دو واکنش مورد بررسی قرار می گیرد.
- واکنش ترکیب گاز هیدروژن با گاز ید:
که در این جا ابتدا اثر افزایش غلظت و اثر یک گاز مثل هلیوم بر روی واکنش مورد بررسی قرار می گیرد اما در مرحله ی بعد که مدنظر است اثر تغییرات دما بر روی واکنش می باشد که در این جا چون واکنش تشکیل هیدروژن یدید گرماده است با افزایش دما واکنش به سمت چپ جابه جا می شود تا طبق اصل لوشاتلیه اثر آن افزایش را خنثی کند. بنابراین رنگ بنفش ظرف مخلوط بیشتر خواهد شد چرا که ید بیشتری تولید می شود اما با کاهش دما، رنگ ظرف به بی رنگی متمایل می شود تا HI را تولید کند.
گروه مدرسه اینترنتی سایت تبیان - تهیه و تنظیم: طیبه موسیوند