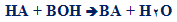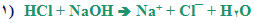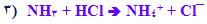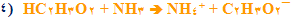نمک چیست؟
به محصول غیر آبی واکنش خنثی شدن اسید و باز، نمک گفته می شود (در واکنش اسید و باز، نمک و معمولا آب تولید می شود؛ این واکنش را واکنش خنثی سازی می نامند).
واکنش خنثی سازی به شکل زیر است:
در شیمی، ٤ واکنش اسید و باز وجود دارد که به تولید نمک منجر می شود:
١) واکنش اسید قوی با باز قوی
٢) واکنش اسید ضعیف با باز قوی
٣) واکنش باز ضعیف با اسید قوی
٤) واکنش اسید ضعیف با با باز ضعیف
مثال برای واکنش های بالا می تواند در قالب های زیر دیده شود:
توجه کنید که محصولات به شکل یونی نوشته شده اند.
نمک هایی که در ٤ نوع واکنش بالا تولید می شوند، محدوده ی pH متفاوتی در محلول خواهند داشت:
١) نمک تولید شده در واکنش اسید قوی و باز قوی، محلولی با pH = ٧ تولید می کند.
٢) نمک واکنش اسید قوی و باز ضعیف، محلولی با pH بزرگ تر از ٧ تولید می کند. به بیان دیگر، نمک اسید ضعیف، محلول بازی تولید می کند. همچنین توجه کنید که عبارت " باز قوی" معمولا حذف شده و عبارت "نمک اسید ضعیف" به کار می رود. البته باز قوی باید حضور داشته باشد تا نمک تولید کند، اما وجود آن فرض گرفته می شود.
٣) نمک اسید قوی و باز ضعیف، محلولی با pH کم تر از ٧ تولید می کند. به بیان دیگر، نمک یک باز ضعیف، محلولی اسیدی تولید می کند. توجه کنید که عبارت " اسید قوی" معمولا حذف شده و عبارت " نمک باز ضعیف" به کار می رود. البته اسید قوی برای تولید نمک باید حضور داشته باشد، اما وجود آن فرض گرفته می شود.
٤) نمک اسید ضعیف و باز ضعیف، محلولی تولید می کند که pH آن به قدرت اسید و باز سازنده نمک بستگی دارد.
محلول های نوع دوم و سوم ذکر شده در بالا، در شیمی بسیار مهم اند. این نکته که محدوده pH مربوط به هر نوع واکنش را به خاطر بسپارید، بسیار مهم است:
به دلیل این که نمک اسید ضعیف، از اسید (که محلولی با pH کم تر از ٧ تولید می کند)حاصل می شود، نمک ها رفتاری مخالف دارند، pH محلول یک نمک اسید ضعیف، بزرگ تر از ٧ خواهد بود (و البته بازی است).
مرحله آخر بایستی با آنیون های اسید قوی مانند Cl¯ و NO٣¯ و کاتیون های بازهای قوی مانندNa+ و K+ انجام شود. آن ها معمولا از هر دو معادله شیمیایی پاک می شوند (که به معادله یونی خالص منجر می شود) . در هر مورد، به جز احتمال برخی موارد، آن ها هیچ تأثیری روی pH نخواهند داشت.