سرعت واکنش شیمیایی

سرعت یک واکنش ، روند تبدیل مواد واکنش دهنده به محصول در مدت زمان معینی را نشان میدهد. سرعت واکنش ها یکی از مهمترین بحث ها در شیمی است. شیمیدان ها همیشه دنبال راهی هستند که سرعت واکنش مفید را بالا ببرند تا مثلا در زمان کوتاه بازده بالایی داشته باشند و یا در پی راهی برای کاهش سرعت یا متوقف ساختن برخی واکنش های مضر هستند. بعنوان مثال رنگ کردن سطح یک وسیله آهنی روشی برای متوقف ساختن و یا کم کردن سرعت زنگ زدگی و جلوگیری از ایجاد اکسید آهن است.
عواملی مؤثر بر سرعت واکنش های شیمیایی
مطالعه سرعت یک واکنش شیمیایی، باعث ایجاد شاخه ای به نام سینتیک شیمیایی شده است. برخی واکنش های شیمیایی سریع و برخی کند هستند. گاهی اوقات شیمیدان ها علاقه به دست کاری واکنش ها دارند؛ به عنوان مثال، برخی واکنش های کند را تند تر می کنند یا برعکس.
عوامل مؤثر بر سرعت یک واکنش به صورت زیر است:

خواص خود واکنش دهنده ها

اندازه ذرات واکنش دهنده ها

غلظت واکنش دهنده ها

فشار واکنش دهنده های گازی

دما

کاتالیست ها
خواص ذاتی واکنش دهنده ها:
برای این که واکنشی اتفاق بیفتد، باید در تمامی واکنش دهنده ها قسمت واکنش دهنده (فعال) مولکول در واکنش شرکت کند. مولکول های بزرگ تر و پیچیده تر، شانس کم تری برای برخورد از قسمت واکنش دهنده (فعال) خود دارند.
گاهی اوقات در مولکول های بسیار پیچیده، قسمت مؤثر مولکول به کلی توسط قسمت های دیگر مولکول پوشیده می شود و هیچ واکنشی اتفاق نمی افتد.
به طور کلی، آهنگ واکنش در مولکول های پیچیده و بزرگ، کندتر است.
اندازه ذره واکنش دهنده های شیمیایی:
هر چه سطح مؤثر برخورد در واکنش دهنده ها بیش تر باشد، واکنش ها با سرعت بیش تری اتفاق می افتند. اگر کبریت روشنی را در مقابل تکه بزرگی از ذغال بگیرید، شاید اتفاق خاصی نیفتد؛ اما اگر همین ذغال را به تکه های بسیار ریز خرد کرده و آن ها را به هوا پرت کنید و کبریتی را روشن کنید، انفجاری را خواهید دید که به دلیل افزایش سطح مؤثر برخورد ذرات واکنش دهنده است.
غلظت واکنش دهنده ها:
افزایش در تعداد برخوردها باعث افزایش سرعت واکنش می شود. تراشه چوب در هوای عادی (که شامل 20 درصد اکسیژن است) به خوبی می سوزد؛ اما همین تراشه در اکسیژن خالص، بسیار سریع تر می سوزد.
در بسیاری از موارد ساده، افزایش غلظت واکنش دهنده ها باعث افزایش سرعت واکنش می شود؛ اما اگر واکنش، پیچده است و مجموعه مراحل واکنشی آن نیز پیچیده است، ممکن است از نتیجه گیری بالا پیروی نکند.
می توانید اثر این نتیجه گیری را در یک واکنش با غلظت های مختلف واکنش دهنده ها مشاهده کنید. اگر در واکنشی، تغییر در غلظت یک واکنش دهنده، هیچ اثری روی آهنگ واکنش نداشت، باید نتیجه بگیرید که این واکنش دهنده در کندترین مرحله مکانیسم (مرحله تعیین سرعت) شرکت نمی کند.
فشار واکنش دهنده های گازی:
فشار واکنش دهنده های گازی، همان اثر غلظت را دارد. هر چه فشار واکنش دهنده بیش تر باشد، آهنگ واکنش سریع تر خواهد بود و این به دلیل افزایش تعداد برخوردها با افزایش فشار است. اما اگر واکنش دهنده ها دارای مکانیسم پیچیده ای باشند، تغییر در فشار ممکن است نتیجه ای که در بالا گرفتیم، نداشته باشد.
تأثیر دما روی سرعت واکنش شیمیایی:
افزایش دما باعث می شود مولکول ها سریع تر حرکت کنند؛ یعنی شانس بیش تری برای برخورد هر مولکول با هر واکنش دهنده ای وجود دارد. اما افزایش دما در عین حال باعث افزایش انرژی جنبشی متوسط مولکلول ها می شود.
شکل زیر نشان دهنده افزایش دما و تاثیر آن روی انرژی جنبشی واکنش دهنده ها و افزایش آهنگ واکنش هاست:
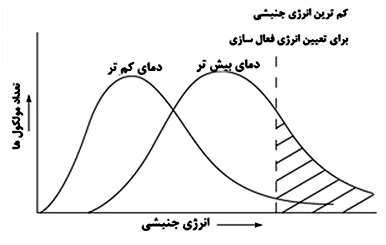
در یک دمای معین، تمام مولکول ها با انرژی جنبشی مشابه حرکت نمی کنند. تعداد کمی از مولکول ها خیلی کند حرکت می کنند (انرژی جنبشی کمی دارند)، در حالی که تعداد کمی از مولکول ها نیز بسیار سریع حرکت می کنند (انرژی جنبشی زیادی دارند). اکثر مولکول ها نیز سرعتی بین این دو سرعت بی نهایت زیاد و کم دارند.
در واقع، دما اندازه ای از انرژی جنبشی متوسط مولکول هاست. همان گونه که در شکل بالا مشاهده می کنید، افزایش دما باعث افزایش انرژی جنبشی متوسط واکنش دهنده ها می شود و منحنی به سمت راست و انرژی های جنبشی بالاتر انتقال پیدا می کند.

به کم ترین مقدار انرژی جنبشی لازم توسط واکنش دهنده ها که انرژی فعال سازی (انرژی مورد نیاز برای ادامه واکنش) را فراهم می کند، توجه کنید. واکنش دهنده ها باید در سمت مواد واکنش دهنده با همدیگر برخورد کنند؛ اما در عین حال مجبورند انرژی کافی برای شکستن پیوندهای یکدیگر را بین هم رد و بدل کنند تا پیوندهای جدید تشکیل شوند. اگر واکنش دهنده ها انرژی کافی نداشته باشند، واکنش ادامه پیدا نمی کند حتی اگر این مولکول ها در سمت واکنش دهنده ها با هم برخورد داشته باشند.
دقت کنید در دمای کم تر، تعداد کم تری از مولکول های واکنش دهنده، دارای حداقل مقدار انرژی جنبشی برای تأمین انرژی فعال سازی هستند. در دماهای بالاتر، بسیاری از مولکول ها کم ترین انرژی جنبشی را به دست می آورند که به معنای تعداد برخوردهای بیش تر و ادامه یافتن واکنش است.
افزایش دما نه تنها تعداد برخوردها را افزایش می دهد؛ بلکه تعداد برخوردهای مؤثر را نیز افزایش می دهد و انتقال انرژی بین واکنش دهنده ها اتفاق می افتد
مرکز یادگیری سایت تبیان - تهیه: مرتضی عرفانیان
تنظیم: مریم فروزان کیا

















