
معادلات خالص یونی

معادلات خالص یونی، معادلاتی اند که تنها الکترولیت های قوی و قابل حل واکنش دهنده را نشان می دهند ( این الکترولیت های قوی را یون می نامند) و شامل یون های ناظر نیستند ( این یون ها در طول واکنش بدون تغییر می مانند و در هر دو طرف واکنش دهنده ها و محصولات، به یک شکل هستند). مثلا در واکنش زیر:
2 NaCl (aq) + CuSO4 (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (s)
شکل یونی این معادله به صورت زیر است:
2 Na+ (aq) + 2 Cl- (aq) + Cu2+ (aq) + SO42- (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (s)

در این جا با برخی از قوانین انحلال پذیری آشنا می شویم که شما مجبورید آن ها را حفظ کنید. این اتفاقات معمولا در محیط های آبی رخ می دهند:
1) بیش تر ترکیبات فلزات قلیایی و ترکیبات NH4+ قابل حل در آب هستند. 2) ترکیبات Cl-، Br-، -I انحلال پذیرند به جز زمانی که شامل یون های Ag+، Hg2+، Pb2+ باشند. 3) ترکیبات شامل F- انحلال پذیرند به جز زمانی که شامل فلزات گروه 2 اصلی باشند. 4) ترکیبات NO3-، ClO3-، ClO4- و CH3COO- انحلال پذیرند. 5) ترکیبات شامل SO4 2- انحلال پذیرند به جز آن هایی که شامل یون های زیر Ca 2+،Sr 2+، Ba 2+، Ag +، Pb 2+ یا Hg 2+ 6) ترکیبات CO3 2-، PO4 3-، C2O4 2-، CrO4 2-، S2-، OH- و O2- انحلال ناپذیرند. 7) اکسیدهای فلزی گروه 2 اصلی، بازهای قوی هستند و چندان انحلال پذیر نیستند. دو قانون انحلال پذیری که شما بیش تر با آن ها سر و کار خواهید داشت، قوانین 1 و 4 هستند. شما باید این نکته را به خاطر بسپارید که فلزات گروه 1 اصلی و ترکیبات آمونیوم انحلال پذیرند. یعنی در هر جا که یون های مربوط به این قانون را دیدید، بلافاصله متوجه می شوید که آن ها انحلال پذیرند. حال سوال این است که بیش ترین حد و مقدار انحلال پذیری چه قدر است؟ اگر یونی انحلال پذیر باشد، پس در محلول خود، رسوب تشکیل نخواهد داد و این به معنای آن است که این یون، واکنش نخواهد داد و جدا از معادله خالص یونی باقی خواهد ماند. نکته کلیدی آن است که فرمول شیمیایی ماده مرکب را نوشته و سپس تعیین کنیم که آیا انحلال پذیر است یا نه. اگر انحلال پذیر است، آن را یونیزه کنیم و اگر نیست، به صورت مولکول ان را رها کنیم.


در این جا برخی قوانین دیگر وجود دارند:
- اگر یک رسوب انحلال ناپذیر یا گاز بتواند در یک واکنش تشکیل شود، احتمال دارد تشکیل شود.
- اکسیدها ( به استثنای اکسیدهای گروه 1اصلی) انحلال ناپذیرند و زمانی که با آب واکنش می دهند، هم اسید (اکسیدهای غیرفلزی) و هم باز (اکسیدهای فلزی) تشکیل می دهند.
- 6 اسید قوی وجود دارند که به طور کامل یونیزه می شوند: HCl، HBr، HI، HNO3، H2SO4، HClO4. تمام اسیدهای دیگر، ضعیف هستند و همگی به صورت مولکولی در معادله نوشته می شوند.
- بازهای قوی که یونیزه می شوند، اکسیدها و هیدروکسیدهای فلزات گروه 1 و 2 اصلی هستند. تمام اکسیدها و هیدروکسیدهای دیگر، ضعیف هستند و همگی به صورت مولکول در معادله نوشته می شوند.
حال با استفاده از قوانین بالا سعی کنید معادله یونی خالص برای ترکیب محلول های نیترات نقره و برومید لیتیوم بنویسید.
Ag+ + NO3- + Li+ + Br- --->
این یک واکنش جابه جایی دوگانه است. هر دو ترکیب، انحلال پذیر هستند؛ پس هر چیزی یونیزه می شود. هر چیزی که تشکیل شود، از بازترکیب دو یون "داخلی" با دو یون "خارجی" به وجود خواهد آمد تا LiNO3 و AgBr تشکیل دهند. اگر هر دوی آن ها انحلال ناپذیر باشند، رسوب تشیکل خواهد شد و یون هایی که واکنش می دهند تا این رسوب را تشکیل دهند، در معادله یونی خالص وجود خواهند داشت و یون های دیگر، ناظر هستند و باید از آن ها صرف نظر کرد.
همان گونه که گفتیم، دو محصول ممکن در این واکنش، نیترات لیتیوم و برومید نقره هستند. از آن جایی که هالیدها به جز هالید نقره، هالید جیوه و هالید سرب، انحلال پذیرند، یک رسوب برومید نقره داریم و معادله یونی خالص ما به صورت زیر است:
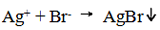
مثال دیگر:
اسید هیدروکلرید و هیدروکسید سدیم را با هم ترکیب می کنیم. معادله یونی خالص آن ها چیست؟
جواب:
همان گونه که می دانید، این دو ماده، اسید و باز قوی هستند؛ برای همین به طور کامل، یونیزه می شوند:
H+ + Cl- + Na+ + OH- ---->

















