
چند استثنا در الگوی کلی انرژی اولین یونش
شکل 1 انرژی اولین یونش عناصر در ردیف دوم جدول تناوبی را نشان می دهد. اگرچه انرژی اولین یونش در حالت کلی با حرکت از چپ به راست جدول تناوبی افزایش دارد، اما در این الگو دو تناقض مشاهده می شود:
انرژی اولین یونش بور از بریلیوم کوچک تر است و اکسیژن نیز اولین انرژی یونش کم تر از نیتروژن دارد.
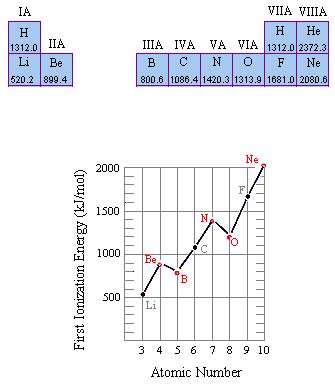
شکل 1: مقادیر انرژی یونش بر حسب تغییرات عدد اتمی
این اثر می تواند با آرایش الکترون در این عناصر توضیح داده شود. زمانی که یک اتم بریلیوم یونیزه می شود، الکترون از اوربیتال 2s بیرون کشیده می شود، اما زمانی که اتم بور یونیزه می شود، الکترون اوربیتال 2p بیرون می آید:
Be: [He] 2s2
B: [He] 2s2 2p1
زمانی که نیتروژن و اکسیژن یونیزه می شوند، الکترون ها باز هم از اوربیتال 2p بیرون کشیده می شوند:
N: [He] 2s2 2p3
O: [He] 2s2 2p4
اما تفاوت مهمی در نحوه ی توزیع الکترون ها در این اتم ها وجود دارد. قاعده ی هوند پیش بینی می کند که هر 3 الکترون در اوربیتال 2p اتم نیتروژن، باید اسپین یکسانی داشته باشند اما در یک اتم اکسیژن، الکترون اضافی در یکی از اوربیتال های 2p جفت می شوند:
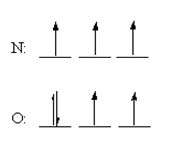
قاعده ی هوند می تواند از این فرض که الکترون ها سعی دارند تا حد ممکن از هم دور باشند تا نیروی دافعه ی بین این دو ذره، کم ترین مقدار را داشته باشد، بهتر درک شود. بنابراین، 3 الکترون در اوربیتال های 2p نیتروژن، وارد اوربیتال های متفاوتی می شوند و اسپین آن ها در جهت یکسانی قرار می گیرد. در اکسیژن، ابتدا 3 الکترون مانند حالت نیتروژن در اوربیتال های متفاوت قرار می گیرند ولی الکترون چهارم باید یکی از اوربیتال های 2p اشغال شده را انتخاب کند.
نیروی دافعه بین این دو الکترون، زمانی کم ترین مقدار را خواهد داشت که این دو الکترون در یکی از اوربیتال ها با هم جفت شوند. با این وجود، هنوز هم مقداری دافعه ی اضافی بین این دو الکترون وجود دارد که این عامل باعث می شود برداشتن یک الکترون از یک اتم خنثای اکسیژن، اندکی راحت تر باشد و این نتیجه با انتظار ما از مؤثر بودن تعداد پروتون های هسته ی اتم مطابقت ندارد.
مرکز یادگیری سایت تبیان - تهیه: خدیجه آلچالانلو
تنظیم: نوربخش

















