نانودارورسانی به مغز با اسب تروا(2)
توزیع زیستى
نقش سورفاكتانت در توزیع نانوذرات در محیط هاى زیستمند.
مطالعات مهمى كه تروستر و همكارانش در خصوص نحوه توزیع ذرات[نانو پلى متیل متاكریلات] C انجام دادند، ثابت كرد كه روكش كردن نانوذرات با سورفاكتانتهایى معین، باعث میشود تا بعد از تزریق وریدى، نانوذرات در مغز موش (صحرایى) تجمع پیدا كنند.
نانوذرات با روكش پلى سوربات 80 تا 3 برابر بیشتر از محلول دالارگین در فضاى همگون مغز تجمع پیدا كردند. نانوذرات روكش شده با پلى سوربات 80 بیشترین غلظت داكسوروبایسین را g/g?) 6 بافت مغز) ظرف مدت 2 تا 4 ساعت درمغز، ایجاد كردند. این غلظت حتى 8 ساعت بعد از تزریق در حد g/g? 1 باقى ماند، در صورتیكه سه تركیب دیگر در سرتاسر زمان آزمایش حتى غلظتشان به حد قابل تشخیص 0/1 g/g?) ) هم نرسید. این 4 محصول اختلاف غلظت ناچیزى را در خون نشان دادند. نكته بسیار جالبى هم در مطالعه كوریر و همكارانش بهدست آمد كه ثابت میكرد غلظت دو فراورده حاوى نانوذرات در قلب به مقدار قابل توجهى كاهش مییابد، اما هم زمان غلظت دو فراورده فاقد نانوذرات در قلب 17 برابر بوده است. از آنجائیكه استفاده از داكسوروبایسین در قلب به جهت تجمع و اثر سمى بالایى كه دارد با محدودیت مواجه است این مشاهده بسیار حائز اهمیت است.
نانوذرات جامد لیپید (SLN) هم میتوانند، بعد از مصرف از طریق داخل وریدى و حتى از طریق دئودنوم(دوازدهه) غلظت قابل توجهى در مغز ایجاد كنند.
غلظت داكسوروبایسین متصل به SLN در مغز mg/kg 6 بعد از 180 دقیقه به ?g/g 2در بافت مغز میرسد این در شرایطى است كه بعد از مصرف محلول داكسوروبایسین به تنهایى كه از طریق ورید جوگولار به موش تزرق شد هیچ اثرى از داكسوروبین در مغز پیدا نشد.
انواع مختلفى از نانوذرات جامد لیپید با اندازهاى حدود 100 نانومتر به وسیلهى لاكمن و كوزیار و همكارانشان ساخته و در جریان خون مغز موش تزریق شد و سپس میزان جذب آنها بهوسیلهی ساكروز و با استفاده از روشهاى آمارى با هم مقایسه شد و مشاهده گردید كه این ذرات توانستهاند بهوسیلهی سیستم اعصاب مركزى دریافت شوند. در عین حال، تزریق نانوذرات هیچ تغییرى در یكپارچگى سد مغزى– خونى و نفوذپذیرى غشاء و یا حتى در انتقال تسهیل شده كولین، ایجاد نكرد.
تومورهاى مغزى
تومورهاى مغزى، مخصوصاً گلیوماى بدخیم از تهاجم ىترین سرطانهایى است كه انسان با آن مواجه است. علیرغم پیشرفتهایى كه در فناورى جراحى اعصاب، درمانهاى حمایتى با شیمى درمانى و پرتودرمانى بهدست آمده، اما سیر بهبودى در این بیماران هنوز بسیار ناخوشایند است. از مشخصههاى این تومورها رشد سریع، انتشار و تهاجم به نقاط دورتر مغز است، علاوهبر این ورم وسیع مغزى و مقادیر زیادى از روند رگ سازى نیز مشاهده میشود. با وجود اینكه سد مغزى- خونى (BBB) در قسمت هسته و مرده (نكروز) تومور، بهطور واضحى شكسته میشود ولى این اتفاق در حاشیه رو به رشد تومور انجام نمیپذیرد. به همین دلیل داروهاى ضد سرطان از قبیل داكسوروبایسین فقط میتوانند به قسمت مرده تومور نفوذ كنند و دارو به قسمتهاى محیطی تریا اصلاً نمیرسد و یا دسترسى بسیار ناچیزى دارد.
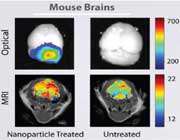
همانطور كه در بالا گفته شد، این دارو در شرایطى كه به نانوذرات پلى بوتیل سیانو آكریلات متصل باشد میتواند به سرعت به غلظتى حدود 6 میكروگرم به ازاء هر گرم در بافت مغز برسد. این نانوذرات در موشهایى كه در داخل جمجمه آنها تومور گلیوبلاستوما 101 پیوند زده شده بود، 101آزمایش شد.
در روزهاى دوم، پنجم و هشتم بعد از پیوند تومور، تركیب [داكسوروبایسین - نانوذرات پلى بوتیل سیانوآكریلات - پلى سوربات 80 ] با دوز1/5mg/kg به موش تزریق شد، در نتیجه متوسط عمر 85 درصد افزایش یافت و با تكرار آن، 20 تا 40 درصد از حیوانات تا 180 روز عمر كردند. سپس حیوانات كشته شدند و در بررس ىهاى بافتشناسى عدم وجود تومورها در این حیوانات به اثبات رسید. در مقایسه با گروههاى كنترل یعنی [نانوذرات پلى بوتیل سیانوآكریلات - پلى سوربات80 ]، محلول [داكسوروبایسین - نانوذرات پلى بوتیل سیانوآكریلات]، افزایشى در طول عمر و تعداد موشهاى زنده مانده مشاهده نشد و یا بسیار ناچیز بود. هیچ سمیتى از نانوذرات در بافتشناسى دیده نشد. همچنین اثر سمى محلول داكسوروبایسین كه معمولاً در سایر دستگاههاى بدن مشاهده میشود در اتصال با نانوذرات كاهش پیدا كرد.
سازوكار دارورسانى بهوسیلهى نانوذرات از طریق سد خونى- مغزى
در حال حاضر سازوكار دارورسانى بهوسیلهى نانوذرات از طریق BBB بهطور كامل روشن نشده است. اما فرضیههاى متعددى مطرح است كه در ذیل به آنها اشاره میشود:
1. افزایش نانوذرات در مویر گهاى مغز متعاقباً باعث افزایش جذب آنها بهوسیلهى دیوارههاى مویرگ میشود. این عمل یك شیب غلظتى ایجاد میكند و باعث میشود این ذرات از جدار سلولهاى آندوتلیال عبور كرده و در نهایت به مغز برسد.
2. پلى سوربات 80 در نقشى كه بهعنوان یك روكش براى نانوذرات دارد، میتواند از سیستم انتشار برگشت، مخصوصاً از عمل پلی گلیکوپروتئین. (Pgp) جلوگیرى كند.
3. با اعمال اثر سمى بر روى عروق مغز، باعث افزایش نفوذپذیرى سلولهاى اندوتلیال میشود.
4. یك اثر عمومى مشابه اثر سورفاكتانت، باعث حل شدن لیپیدهاى موجود در غشاء سلولى میشود و در نتیجه غشاء بهصورت مایع در آمده و باعث افزایش نفوذپذیرى دارو از طریق سد مغزى- خونى میشود.
5. ذرات نانو میتوانند یك شكاف در اتصالات فشرده بین سلولهاى اندوتلیال ایجاد نمایند. سپس داروها به تنهایى یا بهصورت متصل به ذرات نانو، از آن شكاف عبور میكنند.
6. ممكن است نانوذرات به روش اندوسیتوز بهوسیلهى سلولهاى اندوتلیال بلعیده شوند و سپس داروها در داخل سلولها رها شده و از این طریق به مغز برسند.
7. ذرات نانو به همراه داروى متصل شده به روش ترانس سیتوز از لایه سلولهاى اندوتلیال عبور میكنند.
8. تمام این سازوكارها میتوانند با هم عمل كنند.
سازوكا رهاى 1 و 2 بعید به نظر میرسد زیرا: اگر نانوذراتى كه حامل دارو هستند از طریق چسبیدن به دیواره داخلى مویرگ و با ایجاد یك شیب غلظتى بالا عبور كرده باشند (سازوكار 1 )، انتشار دارو هنوز میتواند در سیطره حاملهاى خارج كننده اى باشد كه در غشاءهاى آندوتلیال سلولها وجود دارند. از طرف دیگر، اگر پلى سوربات 80 بتواند این حاملها را مهار كند (سازوكار 2 )، تزریق نانوذرات با روكش پلى سوربات 80 به تنهایى 5 یا 30 دقیقه قبل از تزریق دالارگین، باید باعث تسكین درد شود، كه در این آزمایش مشاهده نشد. این نظر كه سازوكار 1 و 2 در عمل اتفاق نمیافتد، بهوسیلهى مطالعاتى هم كه كوزیارا بر روى مغز انجام داد، تأیید شد.
فرضیههاى 3 و 5 نیز رد مى شوند، زیرا هیچ اثر ضد دردى بعد از تزریق پلى سوربات 80 (فاقد نانوذرات) مشاهده نشد.
علاوه بر این، هیچ پاسخ ضد دردى بعد از تزریق نانوذرات – دالارگین با روكش سورفاكتانتهاى دیگر بهدست نیامد (سازوكار شماره 4، مایع شدن عمومى غشاء).
این عقیده كه علت انتقال دارو بهوسیلهى نانوذرات از BBB به جهت ایجاد اثر سمى بر غشاء نیست در مطالعات سان و كوزیرا ثابت شد . پوشاندن تنها قسمتى از نانوذرات بهوسیلهى پلى سوربات 80 براى دارورسانى به مغز كافى است، مطالعات خونرسانى بافتهاى مغز نشان داد كه نانوذرات نمیتوانند هیچ تغییر واضحى در یكپارچگى BBB نفوذپذیرى غشاء و یا در سیستم ، انتقال تسهیل شده كولین ایجاد كنند. تئورى ایجاد شكاف در اتصالات فشرده كه اساس سازوكار 5 را تشكیل میداد بهوسیلهى یافتههایى كه هیچگونه افزایشى را در فضاهاى اینولین نشان نمیداد، رد شد، علاوه بر این، میكروسكوپ الكترونى هم هیچ شكاف واضحى را در اتصالات فشرده نشان نداد .
بنابراین محتملترین سازوكار، به نظر میرسد كه سازوكار 6 (دریافت نانوذرات حامل دارو بهوسیلهى اندوسیتوز باشد. این سازوكار قبلا در محیط آزمایشگاهى با بافتهاى كشت داده شده سلولهاى اندوتلیال مغز انسان، گاو، خوك، موش خانگى و موش صحرایى نشان داده شده بود در دماى یكنواخت C 37° ، مشاهده شد كه نانوذراتى كه با پلى سوربات 80 روكش شدهاند با سرعت و بهطور قابل ملاحظهاى بهوسیلهى این سلولها برداشت میشوند، در صورتیكه در نمونه بدون روكش بسیار ناچیز بود و در دماى 4°C (دمایى كه در آن فاگوسیتوز انجام نمیشود) و یا بعد از مصرف سیتوكالازین B بازدارنده قوى فاگوسیتوز) متوقف شد.
كریتر بعداً نشان داد كه نانوذرات متصل به دالارگین حتى میتوانند بعد از جذب آپولیپوپروتئینE و B اثرات ضد دردى خود را اعمال نمایند. این اثر حتى بعد از پروراندن پلى سوربات 80 بسیار افزایش یافت. بنابراین سناریوى زیر را میتوان مطرح كرد: نانوذرات به جهت داشتن روكش پلى سوربات بعد از تزریق در خون میتوانند آپولیپوپروتئین E و یا B را جذب كنند. پس این ذرات در نقش ذرات لیپوپروتئین ظاهر شده و بهوسیلهى سلولهاى آندوتلیال مغز كه داراى مقادیر بسیار زیادى از گیرندههاى لیپوپروتئینى هستند به روش آندوسیتوز وابسته به گیرنده، جذب میشوند. با توجه به اینكه حاملهاى انتشار دهنده عمدتاً بر روى غشاء لومینال (مجرایى) قرار دارند، دارو میتواند بعد از رها شدن از ذرات پلیمر (این ذرات بسیار تجزیهپذیر هستند)، بهوسیلهى فرایند انتشار به داخل مغز منتقل شود ( 20 ). اگر چه هنوز هیچ مدرك محكمى در دست نیست ولى این احتمال هم وجود دارد كه نانوذرات بتوانند به روش ترانس سیتوز(سازوكار 7 ) از سلولهاى اندوتلیال عبور كنند. بنابراین به نظر میرسد كه ذرات نانو، نقش « اسب تروا» را در اینجا ایفاء میكنند.
این فرضیه كه دارو از طریق آندوسیتوز نانوذرات به این سلولها ارائه میشود بهوسیلهى سان، كوزیرا و گسنر تأیید شده است. از آنجائیكه گیرندههاى لیپوپروتئین بهوضوح در تومورهاى مغزى وجود دارند ، سناریوى پیشنهادى بالا، عمل متقابل گیرندههاى لیپوپروتئین و اثربخشى تركیب [پلى سوربات 80 – داكسوروبایسین – ذرات نانو] را به خوبى نشان میدهد.
نتیجهگیرى
نانوذرات پلى سیانوآكریلات یا نانوذرات جامد لیپید قادر هستند، بسیارى از داروهاى ضرورى را كه در شرایط معمولى نمیتوانند از سد مغزى - خونى عبور كنند، از این مسیر منتقل نمایند. از نانوذرات همچنین میتوان براى رساندن تركیبات بزرگتر و مولكولهاى پیچیدهتراز قبیل پروتئینها، اسیدهاى نوكلئیك و ژنها براى گذشتن BBB از استفاده كرد. آنها حتى میتوانند باعث بهبودى در درمان تومورهاى مغزى شوند چرا كه با اتصال نانوذرات روكش شده با پلى سوربات 80 میتوان داروهاى ضد تومور را از سد نفوذ ناپذیر BBB ،عبور داد. در نتیجه م ىتوان به مكانهایى كه براى اكثر داروهاى ضد سرطان دور از دسترس است، دست یافت.
اگر چه سازوكار انتقال نانوذرات حامل دارو از BBB هنوز كاملاً روشن نشده است، اما به نظر میرسد كه بعد از تزریق به جریان خون و اتصال با آپولیپوپروتئینها، ابتدا به سلولهاى اندوتلیال مویرگهاى مغز متصل میشوند و به دنبال آن از طریق اندوسیتوز (با واسطه گیرنده ها) وارد سلولهاى اندوتلیال میشوند. این محتملترین اسب » سازوكار مطرح است. بنابراین نانوذرات مانند «اسب تروا» عمل میكند كه میتواند داروها را در داخل این سلولها و یا بعد از ترانس سیتوز، به داخل مغز رها كند.
منبع: ماهنامه فناوری نانو
تنظیم برای تبیان: محسن مرادی